Детская эпилептология (разина е.е.)
Содержание:
- Патогенез фокальной эпилепсии
- 3.8. Эпилепсия затылочной доли
- Образец бланка для интерпретации ЭЭГ
- Особенности клинических проявлений эпилепсии в зависимости от локализации патологического очага
- Причины ВСД
- Материалы и методы
- Симптомы фокальной эпилепсии
- Термины, используемые при расшифровке ЭЭГ
- Аффективно-респираторный синдром: МКБ, классификация
- Диагностика фокальной эпилепсии
- 3.1. Доброкачественная эпилепсия детского возраста с центрально-височными спайками (роландическая эпилепсия)
- Причины эпилепсии у детей
- Где сделать ЭЭГ в СПб? Цена ЭЭГ.
- Общие принципы лечения эпилепсии
- Результаты исследований
Патогенез фокальной эпилепсии
Причинами развития фокальной эпилепсии являются: пороки развития, которые затрагивают ограниченный участок головного мозга (артериовенозные мальформации головного мозга, фокальная корковая дисплазия, врождённые церебральные кисты и т. п.), черепно-мозговые травмы, инфекции (абсцесс головного мозга, энцефалит, нейросифилис, цистицеркоз), нарушения сосудистой системы (перенесенный геморрагический инсульт), метаболическая энцефалопатия, опухоли головного мозга. При ФЭ одними из этиологических факторов при сохранной морфологии нейронов и мозгового вещества в целом могут быть приобретенные и генетически обусловленные метаболические дефекты нейронов некоторой зоны коры больших полушарий.
Перинатальные поражения ЦНС являются ведущей причиной среди факторов возникновения фокальной эпилепсии. Такими поражениями являются: гипоксия плода, асфиксия новорожденного, внутричерепная родовая травма, внутриутробные инфекции. Появление фокального паталогического очага в детском возрасте может быть связано с нарушением созревания коры.
Патофизиологической основой ФЭ выступает эпилептогенный фокус, в котором выделяют несколько зон. Зона патологического повреждения соответствует участку морфологических изменений церебральной ткани, которую можно зафиксировать при помощи МРТ.
Первичная зона — это та часть мозговой коры, в которой генерируются эпи-разряды.
Симптоматогенная зона – это область коры, при возбуждении которой возникает эпилептический приступ. Ирритативная зона— это область, которая регистрируется на ЭЭГ в межприступный промежуток, и является источником эпилептического приступа.
Зона функционального дефицита — это участок, отвечающий за неврологические расстройства, которые сопутствуют эпиприступам.
3.8. Эпилепсия затылочной доли
Общая характеристика
Затылочная эпилепсия — локально обусловленная форма эпилепсии, характеризующаяся преимущественно простыми парциальными пароксизмами, не сопровождающимися нарушением сознания.
Ранние клинические симптомы затылочных эпилепсий обусловлены эпилептической активностью в затылочной доле, а поздние — распространением эпилептической активности на другие области мозга .
Начальные клинические симптомы затылочных пароксизмов включают в себя: простые зрительные галлюцинации, пароксизмальные амавроз и нарушения полей зрения, субъективные ощущения в области глазных яблок, моргания, девиацию головы и глаз в контралатеральную эпилептическому фокусу сторону.
Простые зрительные галлюцинации представлены яркими вспышками света перед глазами, светящимися пятнами, кругами, звездами, квадратами, прямыми или зигзагообразными линиями, которые могут быть одноцветными или многоцветными, неподвижными или перемещающимися в поле зрения.
Пароксизмальный амавроз проявляется в виде нечеткости или временной утраты зрения, ощущающихся как «чернота перед глазами» или «белая пелена перед глазами».
Пароксизмальные нарушения полей зрения проявляются пароксизмальной гемианопсией или квадрантной гемианопсией в течение нескольких секунд или минут .
Субъективные ощущения в области глазных яблок выражаются преимущественно чувством движения глаз при отсутствии объективных симптомов.
Моргание отмечается в самом начале приступа, имеет насильственный характер и напоминает трепетание крыльев бабочки.
Электроэнцефалографические паттерны
Межприступная ЭЭГ может не нести патологических паттернов или представлена эпилептиформной активностью в затылочной или задневисочной области, иногда билатерально. Основная активность может быть не изменена или отмечается ее дезорганизация и земедление. Эпилептиформная активность нередко может быть также ложно представлена в одноименной височной доле (рис. 3.41)
Во время приступа эпилептиформная активность может распространяться с появлением «зеркальных» разрядов.
Образец бланка для интерпретации ЭЭГ
Компьютерное ЭЭГ-обследование
Дата обследования_
Фамилия, имя, отчество_возраст_диагноз_
Общая характеристика электрической активности
1. Организована. 2. Дезорганизована. 3. Гиперсинхронна. 4. Уплощена. 5. Учащена. 6. Замедлена.
-
α-Ритм
- Частота: 7-8, 9-11, 11-13 Гц, неустойчивая.
- Регулярность: регулярен, нерегулярен, в виде групп волн, отсутствует. По данным спектрального анализа ЭЭГ индекс α составляет: амплитуда: снижена, повышена, нормальна; зональные различия: сохранены, снижены; форма α-волны: синусоидальная, заостренная, аркообразная, слабо модулированная.
- Межполушарная асимметрия: нет, слабая, отчетливая.
- β-Активность: частота, амплитуда, локализация, индекс.
- θ-Активность: частота, амплитуда, локализация, индекс.
- δ-Активность: частота, амплитуда, локализация, индекс.
- Пароксизмальная активность: острые волны и пики, множественные пароксизмы, пик-волна, билатер. синхр. вспышки-α, θ, δ.
Функциональные пробы
- Реакция активации (проба с открыванием глаз): реакция отсутствует, слабая, выраженная, провокация пароксизмальной активности или иной патологической активности.
- Гипервентиляция:не изменяет, усиливает α-, θ-, δ-актив., нарастание дизритмии, синхронные пароксизмы θ или δ, генерализованные разряды, локальные пик-волны
- Ритмическая фотостимуляция: депрессия, РУР в узком, широком диапазоне низких, высоких частот, межпол. асим., провоцирование эпи-разрядов.
- Звуковые раздражения:реакция нормальна, усилена, ослаблена
На основании картирования спектров мощности ЭЭГ выявлено: локальные проявления: неотчетливые, асимметрия, преобладание, фокус, очаг;
- топография: правая, левая, асимметрия затылочная, теменная, центральная, лобная, височная;
- стволовые знаки: незначительные, умеренные, выраженные, срединные, передние отделы.
Особенности клинических проявлений эпилепсии в зависимости от локализации патологического очага
Височная форма фокальной эпилепсия является самой часто встречаемой. Эпилептогенный очаг расположен в височной доле головного мозга. Височная фокальная эпилепсия характеризуется припадками с потерей сознания, наличием автоматизмов и ауры. Приступ длится в среднем 30-60 секунд. Оральные автоматизмы присущи детям, а автоматизмы по типу жестов – взрослым. Пароксизмы височной фокальной эпилепсии имеют вторничную генерализацию. Постприступная афазия фиксируется при поражении доминантного полушария височной доли головного мозга.
Эпилептический очаг лобной фокальной эпилепсии расположен в лобной доле головного мозга. Данный очаг провоцирует кратковременные пароксизмы, которые могут проходить сериями. Для лобной ФЭ не характерна аура. Симптомы лобной ФЭ: поворот глаз и головы в одну сторону, сложные автоматические жесты, эмоциональное возбуждение, крики, вздрагивания, агрессия. Если очаг патологии находится в предцентральной извилине, то появляются двигательные пароксизмы джексоновской эпилепсии. Эпилептические приступы лобной фокальной эпилепсии возникают во время сна.
При расположении очага в затылочной доле головного мозга происходят эпилептические приступы, сопровождающиеся нарушением зрения. Например, сужение зрительных полей, зрительные галлюцинации, иктальное моргание, транзиторный амавроз и др. Длительность зрительных галлюцинаций – 13 минут.
Расположение очага эпилептической активности в теменной доле является редкостью. Теменная доля поражается в случае наличия опухоля или корковой дисплазии. Теменная фокальная эпилепсия характеризуется простыми соматосенсорными пароксизмами: кратковременная афазия или паралич Тодда. Если зона эпилептической активности локализуется в постцентральной извилине, то могут происходить джексоновские припадки.
Причины ВСД
В основе заболевания — нарушение нейрогуморальной регуляции вегетативной нервной системы, отвечающей за стабильность и слаженность деятельности всех внутренних органов и организма в целом. Это отдел нервной системы, не подчиняющийся сознанию и управлению волей человека.
Причин заболевания много. Среди первых выступают гормональные нарушения, в том числе преходящие — в период полового созревания, менопаузы, беременности. Существенную роль играют инфекционные болезни (в том числе и физическая детренированность после инфекции), очаги хронической инфекции (кариес, синусит, тонзиллит), аллергия. Предрасполагают к расстройству психоэмоциональное перенапряжение ,черепно-мозговые травмы, малоподвижный образ жизни, вредные привычки — курение, алкоголь, неправильное питание
Важное значение имеет наследственная предрасположенность
Материалы и методы
Обследовано 22 пациента с СФ (13 женщин и 9 мужчин, средний возраст 31,59 ± 2,19 года) и 20 здоровых испытуемых (12 женщин и 8 мужчин, средний возраст 30,58 ± 1,96 года). Диагноз социальных фобий соответствовал критериям МКБ-10 — F40.1 .
В качестве электрофизиологического метода использовалась методика топоселективного картирования ЭЭГ. Усиление и фильтрация ЭЭГ осуществлялись с помощью усилителей MBA-32 («Медикор», Венгрия). Полоса пропускания составляла 0,5–70 Гц, чувствительность — 200 мкВ/дел. Регистрация проводилась по 16 каналам при монополярном монтаже электродов с объединенным ушным референтом. Электроды располагались в соответствии с международной системой «10–20 %». Заземляющий электрод помещался на лбу испытуемого. Сопротивление между заземляющим и регистрирующими электродами составляло менее 5 кОм. Усиленные биоэлектрические сигналы поступали через аналого-цифровой преобразователь L780 («Л-Кард», Россия) (частота дискретизации 128 Гц, разрядность 14 бит) в компьютер IBM PC Pentium и сохранялись на жестком диске. Для регистрации и обработки ЭЭГ использовалась лицензионная программа «Brain Surfing» (Россия).
ЭЭГ регистрировалась в состоянии спокойного бодрствования. После удаления артефактов анализировались десять восьмисекундных участков ЭЭГ. Проводился компрессионный спектральный анализ (КСА) ЭЭГ с использованием алгоритма быстрого преобразования Фурье для вычисления показателей абсолютной (мкВ2/Гц) спектральной плотности мощности сигнала ритмов следующих частотных диапазонов: дельта — от 0,5 до 3 Гц; тета — от 4,0 до 7 Гц; альфа — от 8 до 13 Гц; бета-1 — от 14 до 18 Гц; бета-2 — от 19 до 32 Гц. Дельта- и бета-2-диапазоны в дальнейшем не анализировались из-за невозможности достаточно полного исключения артефактов. Степень межполушарной асимметрии (МПА) определялась для каждого анализируемого ритма ЭЭГ по формуле:
коэффициент МПА = ((П – Л)/(П + Л)) · 100 % ,
где П — значение спектральной мощности определенной частотной составляющей ЭЭГ в правом полушарии, а Л — в левом полушарии. (Все больные и здоровые испытуемые были правшами.)
Статистическая обработка полученных данных проводилась с использованием пакета программ «Statistica 6.0 for Windows». Для оценки достоверности изменений показателей применялся параметрический t-критерий Стьюдента.
Симптомы фокальной эпилепсии
Фокальная эпилепсия характеризуется парциальными фокальными эпилептическими пароксизмами. Пароксизмы бывают простые, не сопровождающиеся потерей сознания, и сложные, без утраты сознания. Простые парциальные эпилептические припадки бывают вегетативными, соматосенсорными, моторными, сенсорными, с галлюцинаторным компонентом и с психическими расстройствами.
Сложные парциальные эпилептические приступы могут начинаться как простые, но затем происходит повреждение сознания. После припадка может быть спутанность сознания.
Вторично генерализованные парциальные припадки начинаются как простой или сложный фокальный приступ, но затем возбуждение переходит и на другие отделы коры головного мозга. Таким образом пароксизм приобретает клонико-тонический вид. У больного могут фиксироваться различные виды парциальных пароксизмов.
Симптоматическая фокальная эпилепсия сопровождается той симптоматикой, которая соответствует основному поражению мозга. Данный вид эпилепсии характеризуется снижением интеллекта, задержкой психического развития и нарушением когнитивной сферы ребенка.
Идиопатическая фокальная эпилепсия доброкачественна, и не характеризуется нарушениями психических и интеллектуальных сфер.
Термины, используемые при расшифровке ЭЭГ
При диагностической оценке ЭЭГ учитывают частотный состав ЭЭГ, ее компоненты и характер организации (паттерн) биоэлектрической активности
Чтобы правильно описать и интерпретировать ЭЭГ, важно хорошо владеть специальной терминологией, принятой Международной федерацией клинической нейрофизиологии
Волна – одиночное колебание потенциала любой амплитуды и формы.
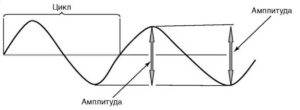 Схема определения амплитуды и периода отдельной волны
Схема определения амплитуды и периода отдельной волны
Амплитуда волны – величина колебания потенциала от пика до пика, измеряется в микровольтах и милливольтах.
Период (цикл) – длительность интервала между началом и концом одиночной волны или комплекса волн. Период отдельных волн ритма ЭЭГ обратно пропорционален частоте этого ритма.
Частота – число волн или комплексов волн в секунду.
Полоса частот – часть спектра синусоидальных колебаний электромагнитных излучений, лежащая в определенных пределах.
Диапазон частот – участок частотного спектра изменчивости потенциалов головного мозга, ограниченный определенными частотными рамками. Современная классификация частот выделяет следующие диапазоны: δ-диапазон – 0,5-4 колебаний/с, θ-диапазон – 4,5-7 колебаний/с, α-диапазон – 8-12 колебаний/с, ß1-диапазон – 16-20 колебаний/с, ß2-диапазон – 20-35 колебаний/с, γ-диапазон – выше 35 колебаний/с.
Компонент – любая отдельная волна или комплекс волн, различаемых на ЭЭГ.
Комплекс (волновой комплекс) – активность, состоящая из двух или нескольких волн характерной формы, отличных от основного фона, и имеющая тенденцию сохранять свою структуру при повторении.
Ритм ЭЭГ – спонтанная электрическая активность мозга, состоящая из волн, имеющих относительно постоянный период).
На ЭЭГ взрослого человека выделяют α- и ß-ритмы, а также сенсо-моторный, или σ-ритм – 13-15 колебаний/с.
Патологическими для взрослого бодрствующего человека являются δ- и θ-ритмы.
 Примеры электроэнцефалографических ритмов различных частотных диапазонов
Примеры электроэнцефалографических ритмов различных частотных диапазонов
Индекс – относительный показатель выраженности какой-либо активности ЭЭГ. Индекс α (θ, δ и т.д.) – время (в %), в течение которого на каком-либо отрезке кривой выражена данная активность. Интегральный индекс, характеризующий структуру ЭЭГ в целом, отношение интенсивности быстрых (α + ß) и медленных (δ- и θ-) ритмов.
Визуальный анализ ЭЭГ включает описание главных, наиболее выраженных компонентов α-, ß-, θ- и δ-ритмов по степени выраженности, частоте, амплитуде (очень низкая – до 10 мкВ, низкая – до 20 мкВ, средняя – 40-50 мкВ, высокая до 70-80 мкВ, очень высокая – выше 80 мкВ) и по зональным различиям.
Кроме того, отмечают локальные патологические знаки, наличие пароксизмальной и эпилептической активности, описывают отдельные типы биоэлектрических потенциалов и их характер.
Footnotes
- Зенков Л.Р. Электроэнцефалография. В кн.: Зенков Л.Р., Ронкин М.А. Функциональная диагностика нервных болезней. 2-е издание. М.: Медицина. 1991, с. 7-146.
- Friedlander W. J. Equivocation in EEG Reporting: the clinicians responce. Clin, electroencephalogr., 1979, v. 10, p. 219—221.
- Maurer К. et а!., 1989; GiannitrapaniD. etal., 1991; IznakA.F. etal., 1992
- Nagata К., 1990
- Болдырева Г.И., 1994
- Зимкина A.M., Домонтович Е.Н., 1966
- Maurer К. etal., 1989
- MoultonR. etal., 1988
- Русинов B.C., Гриндель О.М., 1987
- Монахов К.К. и др., 1983; Стрелец В.Б., 1990
- Карлов В.А., 1990; Сараджишвили П.М., Геладзе Г.Ш., 1977; PenfieldW., JasperH.H., 1954
Аффективно-респираторный синдром: МКБ, классификация
- Легкая стадия. Длится около 15 секунд, ребёнок не способен нормально дышать. Опасности для мозга нет, но всё равно стоит обратиться к неврологу.
- «Бледная» стадия. Возникает из-за внешних факторов. Например, из-за боли, удара, укола или падения. При приступах, у ребёнка наблюдается бледность, он может упасть в обморок. Аффективные симптомы типа плача или крика могут не проявляться.
- «Синяя» стадия. Катализатором приступов является окружающая обстановка: стресс, давление, сильное возбуждение. Симптомами при этой стадии являются: кожа становится синей, апноэ длится около 20 секунд, в редких случаях проявляются судороги.
- Осложнённый Аффективно-респираторный синдром. Часто проявляется у грудничков. Данная стадия отличается от прошлых своей сложностью и длительностью приступов. Синдром проявляется не только из-за темперамента или характерных особенностей, но и из-за проблем с ЦНС.
Диагностика фокальной эпилепсии
Если парциальный пароксизм возник впервые, то пациенту необходимо детальное обследование, так как данный симптом может быть проявлением серьезной церебральной патологии. Во время консультации врач-невролог просит полностью описать длительность, характер, последовательность развития эпилептического приступа. Выявленные отклонения помогают установить расположение очага патологии.
Эпилептическая активность диагностируется с помощью ЭЭГ. Эпи-активность фокальной эпилепсии можно зафиксировать на ЭЭГ даже в межприступный период. Если ЭЭГ без приступа малоинформативна, то следует провести электроэнцефалоскопию с провокационными пробами и/или во время приступа. Субдуральная кортикография – это электроэнцефалоскопия с установлением электродов под твердой мозговой оболочкой. Помогает точно определить локализацию патологического очага.
Из инструментальных методов исследований наиболее эффективным для выяснения морфологических основ ФЭ является МРТ. Толщина срезов должна составлять около 1-2 мм, чтобы как можно точнее обнаружить мельчайшие дефекты вещества головного мозга. В случае симптоматической эпилепсии МРТ даёт возможность выявить первопричину: очаговые поражения, атрофии, дисплазии. В ряде случаев обнаружить подобные изменения не удается и тогда диагноз — идиопатическая или криптогенная ФЭ. В качестве дополнительного, но необязательного исследования может быть назначена ПЭТ головного мозга. ПЭТ зафиксирует эпилептогенный участок как зону повышенной метаболической активности. ОФЭКТ также применяется в качестве дополнительного метода диагностики, в ходе которого специалист способен отслеживать динамику перфузии церебрального вещества: в течение припадка будет наблюдаться картина гиперперфузии эпилептогенного очага, а в отрезок времени между пароксизмами — гипоперфузия.
3.1. Доброкачественная эпилепсия детского возраста с центрально-височными спайками (роландическая эпилепсия)
Общая характеристика
Роландическая эпилепсия — одна из форм идиопатической локально обусловленной эпилепсии детского возраста, проявляющаяся преимущественно ночными короткими гемифациальными моторными приступами и имеющая благоприятный прогноз.
Роландическая эпилепсия проявляется в возрасте 2–14 лет. Приступы могут быть парциальными и вторично-генерализованными. Большинство парциальных приступов являются моторными. Типичные приступы, возникающие как в состоянии бодрствования, но все чаще во время сна (преимущественно первая половина ночи), протекают обычно при сохранном сознании и начинаются с соматосенсорной ауры, характеризующейся парестезией щеки, мышц глотки и гортани, ощущением булавочных уколов, онемения в щеке, деснах, языке на стороне, противоположной фокусу. Затем появляются моторные феномены в виде односторонних гемифациальных (с вовлечением лицевой мускулатуры) клонических или тонико-клонических судорог, которые могут распространяться на гомолатеральную руку (фацио-брахиальные приступы) и ногу (унилатеральные приступы).
В начале приступа или в процессе его развития возникают затруднения речи, выражающиеся в полной невозможности говорить или произносить отдельные звуки. Наряду с анартрией отмечается гиперсаливация, характеризющаяся обильной продукцией и выделением изо рта слюны, что способствует возникновению хлюпающих, хрюкающих звуков.
Длительность приступов, как правило, не более 2–3 мин, частота в среднем — 2–6 раз в год .
При роландической эпилепсии в единичных случаях возможно развитие эпилептического статуса .
Для больных с роландической эпилепсии характерен нормальный интеллект и неврологический статус, хотя ряд современных исследователей все же указывают на наличие у таких детей нейропсихологической недостаточности .
Ряд авторов отмечают возможность возникновения при роландической эпилепсии приступов, характеризующихся болями в животе, головокружением, зрительными феноменами (вспышки света, слепота, мелькание предметов перед глазами), которые обычно отмечаются у детей моложе 5 лет; сложных парциальных приступов или типичных абсансов .
К атипичной роландической эпилепсии (синдром псевдоленнокса) относят группу больных в возрасте 2–8 лет, у которых отмечаются простые парциальные гемифациальные и гемиклонические ночные приступы, сочетающиеся с миоклонически-астатическими, атоническими пароксизмами и в ряде случаев с абсансами , но никогда в отличие от истинного синдрома Леннокса-Гасто не бывает тонических судорог . Частота приступов обычно высокая. До дебютирования приступов у детей не отмечается нарушений в нервно-психическом развитии.
Электроэнцефалографические паттерны
Приступная и межприступная ЭЭГ у больных с роландической эпилепсией характеризуется нормальной основной активностью и обычно дифазными спайками, за которыми следует медленная волна. Спайки или острые волны появляются одиночно или группами в средне-височной и центральной области или височно-центрально-теменной области . Они могут наблюдаться как унилатерально (обычно контралатерально гемифациальным приступам), так и билатерально (синхронно или асинхронно). «Роландические» комплексы обычно наиболее отчетливо выражены при открытых глазах (рис. 3.1).
В ряде случаев на ЭЭГ регистрируются генерализованные комплексы «спайк-волна», типичные для абсансов. Острые волны также могут располагаться в затылочной области . Также во время ночного приступа на ЭЭГ может регистрироваться низкоамплитудная быстрая активность в центрально-височной области, переходящая в роландические комплексы с распространением на всю гемисферу и с последующей генерализацией .
При атипичной роландической эпилепсии (синдром псевдоленнокса) фоновая ЭЭГ не изменена либо слегка замедлена и дизорганизована (рис. 3.2а), в ряде случаев, преимущественно в лобных отделах. Типичные роландические спайки могут сочетаться с медленными комплексами «острая-медленная волна», характерными для синдрома Леннокса-Гасто, или нерегулярной диффузной пик-волновой активностью частотой около 2,5 кол./с и амплитудным региональным преобладанием в лобных отделах; могут определяться фокальные спайки или медленные волны в центрально-височной области или центрально-височно-теменной области (рис. 3.2б).
В приступной ЭЭГ может отмечаться асинхронное появление разрядов высокоамплитудных нерегулярных диффузных комплексов «пик-волна» или «острая-медленная волна» частотой 1.5–4 кол./с длительностью 3–10 с, синхронно с пароксизмом атипичных абсансов .
Причины эпилепсии у детей
Мнение о том, что эпилепсия – исключительно наследственное заболевание, современными врачами не поддерживается. Некоторые ее формы не наследуются, некоторые являются следствием структурного поражения головного мозга (фокальные корковые дисплазии, врожденные аномалии развития головного мозга, туберозный склероз, ганглиомы и др.). Также нельзя однозначно утверждать, что к эпилепсии приводят какие-либо перенесенные человеком заболевания, однако они могут ускорить наступление болезни. Таковыми факторами являются:
- родовые травмы, возникновение кислородной недостаточности при рождении;
- черепно-мозговые травмы;
- кровоизлияния в мозг;
- новообразования в головном мозге (кисты, гематомы, опухоли);
- абсцесс мозга;
- инфекционные, паразитарные, вирусные заболевания;
- менингит, энцефалит.
Чем опасна эпилепсия у детей
- Во время приступа ребенок может получить серьезную травму, задохнуться рвотными массами, прикусить язык или щеку.
- Кроме этого, у детей бывают частые и тяжелые приступы с малым интервалом, когда они попросту не могут прийти в себя.
- Из-за постоянных приступов может сформироваться хроническая пневмония, развиться умственная отсталость.
Где сделать ЭЭГ в СПб? Цена ЭЭГ.
Пациентам психоневрологического диспансера № 1 по направлениям лечащих врачей психиатров/психотерапевтов ЭЭГ выполяется бесплатно.
На хозрасчетном отделении Центра психического здоровья (12 линия В.О., дом 39) можно сделать клиническое ЭЭГ исследование со всеми стандартными пробами с расшифровкой платно (1000 руб). Звоните +7 (812) 246-11-51
Обратите внимание! Многие частные медицинские центры с целью снижения стоимости исследования или выполняют только «фоновую ЭЭГ» (это приблизительно 20% от общего протокола исследования по существующим международным стандартам) или проводят исследование без расшифровки и заключения врача (последние как правило включены в прейскурант еще одной строкой со своей собственной ценой)
Общие принципы лечения эпилепсии
В настоящее время выработаны общепринятые международные стандарты по лечению эпилепсии, которые необходимо соблюдать для повышения эффективности лечения и улучшения качества жизни пациентов.
Лечение эпилепсии может быть начато только после установления точного диагноза. Термины “предэпилепсия” и “профилактическое лечение эпилепсии” являются абсурдными. Существуют две категории пароксизмальных неврологических расстройств: эпилептические и неэпилептические (обмороки, снохождения, ночные страхи и пр.), и назначение АЭП оправдано только в случае эпилепсии. По мнению большинства неврологов, лечение эпилепсии следует начинать после повторного приступа. Единичный пароксизм может быть “случайным”, обусловленным лихорадкой, перегревом, интоксикацией, метаболическими расстройствами и не относиться к эпилепсии. В этом случае немедленное назначение АЭП не может быть оправданным, так как данные препараты являются потенциально высокотоксичными и не применяются с целью “профилактики”. Таким образом, АЭП могут применяться только в случае повторных непровоцируемых эпилептических приступов (т.е. при эпилепсии по определению).
В случае установления точного диагноза эпилепсии необходимо решить вопрос, следует или нет назначать АЭП? Разумеется, в подавляющем большинстве случаев, АЭП назначаются немедленно после диагностирования эпилепсии. Однако при некоторых доброкачественных эпилептических синдромах детского возраста (прежде всего, при роландической эпилепсии) и рефлекторных формах эпилепсии (эпилепсия чтения, первичная фотосенситивная эпилепсия и др.), допускается ведение пациентов без применения АЭП. Подобные случаи должны быть строго аргументированы.
Диагноз эпилепсии установлен и решено назначить АЭП. С 1980-х годов в клинической эпилептологии прочно утвердился принцип монотерапии: купирование эпилептических приступов должно осуществляться преимущественно одним препаратом. С появлением хроматографических методов определения уровня АЭП в крови стало очевидным, что многие антиконвульсанты имеют взаимный антагонизм, и одновременное их применение может значительно ослабить противосудорожный эффект каждого. Кроме того, применение монотерапии позволяет избежать возникновения тяжелых побочных эффектов и тератогенного воздействия, частота которых значительно возрастает при назначении нескольких препаратов одновременно. Таким образом, в настоящее время полностью доказана несостоятельность старой концепции о назначении большого количества АЭП одновременно в малых дозах. Политерапия оправдана только в случае резистентных форм эпилепсии и не более 3-х АЭП одновременно.
Подбор АЭП не должен быть эмпирическим. АЭП назначаются строго в соответствии с формой эпилепсии и характером приступов. Успех лечения эпилепсии во многом определяется точностью синдромологической диагностики (табл. 3).
АЭП назначаются, начиная с малой дозы, с постепенным увеличением до достижения терапевтической эффективности или появления первых признаков побочных эффектов. При этом определяющим является клиническая эффективность и переносимость препарата, а не содержание его в крови (табл. 4).
В случае неэффективности одного препарата, он должен быть постепенно заменен другим АЭП, эффективным при данной форме эпилепсии. При неэффективности одного АЭП нельзя сразу прибавлять к нему второй препарат, то есть переходить на политерапию не используя всех резервов монотерапии.
Принципы отмены АЭП.
АЭП могут быть отменены спустя 2,5-4 года полного отсутствия приступов. Клинический критерий (отсутствие приступов) является основным критерием отмены терапии. При большинстве идиопатических форм эпилепсии отмена препаратов может осуществляться через 2,5 (роландическая эпилепсия) — 3 года ремиссии. При тяжелых резистентных формах (синдром Леннокса-Гасто, симптоматическая парциальная эпилепсия), а также при юношеской миоклонической эпилепсии, данный период увеличивается до 3-4 лет. При продолжительности полной терапевтической ремиссии в течение 4-х лет, лечение должно быть отменено во всех случаях. Наличие патологических изменений на ЭЭГ или пубертатный период пациентов не являются факторами, задерживающими отмену АЭП при отсутствии приступов более 4-х лет.
Не существует единого мнения по вопросу о тактике отмены АЭП. Лечение может быть отменено постепенно в течение 1-6 мес или одномоментно по усмотрению врача.
часть-1 часть-2
Результаты исследований
Здоровые испытуемые характеризовались преобладанием на ЭЭГ альфа-активности, более выраженной в правом полушарии, и средними значениями коэффициента МПА, что согласуется с данными литературы . Пациенты с СФ отличались от здоровых испытуемых достоверно более низкими значениями показателей плотности мощности альфа-ритма в центральном (16,53 ± 1,68 мкВ2/Гц и 21,21 ± 1,89 мкВ2/Гц соответственно, p < 0,03) и теменном (22,56 ± 2,91 мкВ2/Гц и 28,74 ± 3,03 мкВ2/Гц соответственно, p < 0,02) отведениях правого полушария. Кроме того, у пациентов по сравнению со здоровыми было обнаружено достоверное увеличение плотности мощности бета-ритма в правом затылочном отведении (10,35 ± 1,08 мкВ2/Гц и 6,93 ± 0,61 мкВ2/Гц соответственно, p < 0,05), а также возрастание плотности мощности тета-ритма во всех отведениях правого полушария, не достигающее, однако, степени достоверности.
Наиболее значительные изменения, зарегистрированные нами у больных СФ, касались коэффициентов МПА. У пациентов наблюдалось достоверное уменьшение (p < 0,04) коэффициентов МПА для альфа-ритма в передней височной и центральной областях, а также «инверсия» (p < 0,004–0,03) МПА в средней височной и теменной областях, с преобладанием альфа-активности в этих областях в левом полушарии. Кроме того, у пациентов, наряду с достоверным снижением (p < 0,02–0,03) коэффициентов МПА для бета-ритма в средних височных и центральных областях, регистрировалась «инверсия» (p < 0,009–0,02) коэффициентов МПА в лобных, передних височных, задних височных, затылочных областях, с доминированием бета-активности в этих отделах в правом полушарии. И наконец, у больных отмечалось достоверное изменение (p < 0,05) коэффициентов МПА для тета-ритма в лобных и передних височных областях, с преобладанием тета-активности в этих областях в правом полушарии (табл. 1).
2006/41/2.png)
Таким образом, у пациентов с СФ были зарегистрированы значительные изменения плотности мощности и МПА во всех частотных диапазонах ЭЭГ.



